Tabel Periodik – Unsur kimia adalah zat kimia yang tidak dapat dibagi lagi (diubah menjadi zat yang kecil) jika menggunakan metode kimia yang biasa.
Jumlah unsur totalnya ada 118 unsur. Bisa dilihat di tabel periodik di bawah.
Daftar Isi
Pengertian Tabel Periodik
Pengertian tabel periodik adalah tabel yang menampilkan unsur – unsur kimia.
Unsur – unsur tersebut di susun berdasarkan nomor atom yaitu jumlah proton dalam inti atom, konfigurasi elektron, dan keberulangan sifat kimia.
Tabel periodik terbagi menjadi 4 blok, yaitu blok -s, -p, -d, dan -f.
Secara umum, dalam satu periode atau baris, di sebelah kiri bersifat logam, dan di sebelah kanan bersifat non-logam.
Ciri – Ciri Unsur Logam
- Kerapatan pada unsurnya tinggi
- Unsur bersifat konduktor
- Padat (dapat dibentuk/ditempa)
Ciri – Ciri Unsur Non Logam
- Kerapatan pada unsurnya rendah
- Unsur bersifat isolator
- Rapuh
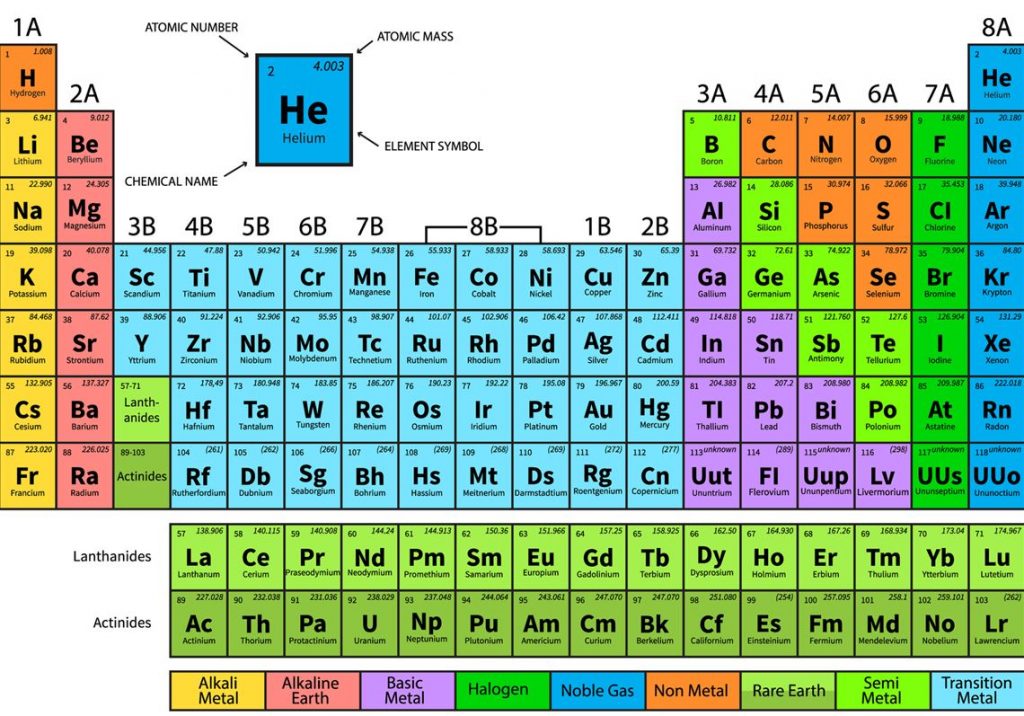
Untuk lebih detailnya dapat dilihat di gambar tabel periodik di bawah ini
Tabel Periodik Unsur

Keterangan Tabel Periodik
- Baris pada tabel di sebut dengan periode, lalu kolom di sebut dengan golongan.
- Ada 6 golongan ( kolom ) mempunyai nama selain nomor. Contoh nya adalah unsur golongan 17 ialah halogen, dan golongan 18 nya ialah gas mulia.
- Tabel periodik dapat digunakan untuk menurunkan hubungan antara sifat – sifat unsur, dan memperkirakan sifat unsur baru yang belum ditemukan.
- Tabel periodik memberikan kerangka kerja untuk melakukan analisis perilaku kimia, banyak digunakan dalam bidang kimia.
Keterangan Unsur Kimia di Tabel Periodik
| No atom | Simbol | Unsur Kimia |
| 1 | H | hidrogen |
| 2 | He | helium |
| 3 | Li | lithium |
| 4 | Be | beryllium |
| 5 | B | boron |
| 6 | C | carbon |
| 7 | N | nitrogen |
| 8 | O | oxygen |
| 9 | F | fluorine |
| 10 | Ne | neon |
| 11 | Na | sodium |
| 12 | Mg | magnesium |
| 13 | Al | aluminum |
| 14 | Si | silicon |
| 15 | P | phosphorus |
| 16 | S | sulfur |
| 17 | Cl | chlorine |
| 18 | Ar | argon |
| 19 | K | potassium |
| 20 | Ca | calcium |
| 21 | Sc | scandium |
| 22 | Ti | titanium |
| 23 | V | vanadium |
| 24 | Cr | chromium |
| 25 | Mn | manganese |
| 26 | Fe | iron |
| 27 | Co | cobalt |
| 28 | Ni | nickel |
| 29 | Cu | copper |
| 30 | Zn | zinc |
| 31 | Ga | gallium |
| 32 | Ge | germanium |
| 33 | As | arsenic |
| 34 | Se | selenium |
| 35 | Br | bromine |
| 36 | Kr | krypton |
| 37 | Rb | rubidium |
| 38 | Sr | strontium |
| 39 | Y | yttrium |
| 40 | Zr | zirconium |
| 41 | Nb | niobium |
| 42 | Mo | molybdenum |
| 43 | Tc | technetium |
| 44 | Ru | ruthenium |
| 45 | Rh | rhodium |
| 46 | Pd | palladium |
| 47 | Ag | silver |
| 48 | Cd | cadmium |
| 49 | In | indium |
| 50 | Sn | tin |
| 51 | Sb | antimony |
| 52 | Te | tellurium |
| 53 | I | iodine |
| 54 | Xe | xenon |
| 55 | Cs | cesium |
| 56 | Ba | barium |
| 57 | La | lanthanum |
| 58 | Ce | cerium |
| 59 | Pr | praseodymium |
| 60 | Nd | neodymium |
| 61 | Pm | promethium |
| 62 | Sm | samarium |
| 63 | Eu | europium |
| 64 | Gd | gadolinium |
| 65 | Tb | terbium |
| 66 | Dy | dysprosium |
| 67 | Ho | holmium |
| 68 | Er | erbium |
| 69 | Tm | thulium |
| 70 | Yb | ytterbium |
| 71 | Lu | lutetium |
| 72 | Hf | hafnium |
| 73 | Ta | tantalum |
| 74 | W | tungsten |
| 75 | Re | rhenium |
| 76 | Os | osmium |
| 77 | Ir | iridium |
| 78 | Pt | platinum |
| 79 | Au | gold |
| 80 | Hg | mercury |
| 81 | Tl | thallium |
| 82 | Pb | lead |
| 83 | Bi | bismuth |
| 84 | Po | polonium |
| 85 | At | astatine |
| 86 | Rn | radon |
| 87 | Fr | francium |
| 88 | Ra | radium |
| 89 | Ac | actinium |
| 90 | Th | thorium |
| 91 | Pa | protactinium |
| 92 | U | uranium |
| 93 | Np | neptunium |
| 94 | Pu | plutonium |
| 95 | Am | americium |
| 96 | Cm | curium |
| 97 | Bk | berkelium |
| 98 | Cf | californium |
| 99 | Es | einsteinium |
| 100 | Fm | fermium |
| 101 | Md | mendelevium |
| 102 | No | nobelium |
| 103 | Lr | lawrencium |
| 104 | Rf | rutherfordium |
| 105 | Db | dubnium |
| 106 | Sg | seaborgium |
| 107 | Bh | Bohrium |
| 108 | Hs | Hassium |
| 109 | Mt | meitnerium |
| 110 | Ds | Darmstadtium |
| 111 | Rg | Roentgenium |
| 112 | Cn | Copernicium |
| 113 | Uut | Ununtrium |
| 114 | Uuq | Ununquadium |
| 115 | Uup | Ununpentium |
| 116 | Uuh | Ununhexium |
| 117 | Uus | Ununseptium |
| 118 | Uuo | Ununoctium |
Cara Membaca Tabel Periodik

Penjelasan dari gambar diatas yaitu Mg merupakan lambang dari unsur Magnesium.
Pada unsur tersebut memiliki nomor atom 12 serta untuk nomor massanya ialah 24.31.
Unsur – Unsur Dalam Sistem Periodik
Golongan IA ( Logam Alkali )
Untuk golongan IA semua logamnya tergolong logam yang lunak kira – kira sekeras karet penghapus.
Dapat diiris dengan pisau, serta massa jenisnya ringan.
li, Na, dan K semua nya kurang dari 1 g/cm3.
Golongan IIA ( Logam Akali Tanah )
Logam alkali tanah atau di singkat IIA tergolong logam yang aktif.
Kereaktifannya kurang dibandingakan dengan logam alkali seperiode.
Hanya bisa terbakar di udara bila dipanaskan, kecuali dengan berelium karna logam alkali tanah hanya larut dalam air.
Dgunakan sebagai obat mag dalam kesehatan.
Golongan VIIA ( Halogen )
Golongan dari VIIA merupakan kelompok unsur nonlogam yang sangat reaktif.
Hal itu berkaitan dengan elektron valensinya yang berjumlah 7, sehingga hanya memerlukan tambahan 1 elektron saja untuk mencapai konfigurasi stabil seperti contoh pada gas mulia.
Golongan VIIIA ( Gas Mulia )
Unsur – unsur dari golongan VIIIA, yaitu helium, Neon, Argon, Kripton, Xenon, sangat susah bereaksi dengan unsur yang lainnya.
Di dalam nya tidak ditemukan satu pun senyawa alami dari unsur – unsurnya.
Golongan B ( Unsur Transisi )
Lalu pada transisi adalah unsur – unsur golongan tambahan ( golongan B ).
Seluruh unsur dari nomor atom 1 ( hidrogen ) hingga 118 ( oganesson ) telah ditemukan.
Dengan penambahan terbaru (nihonium, moscovium, tennessine, dan oganesson) yang telah dikonfirmasi oleh International Union of Pure and Applied Chemistry ( IUPAC ) pada tanggal 30 Desember 2015 dan secara resmi telah diberi nama pada tanggal 28 November 2016, mereka menyelesaikan 7 baris pertama Tabel periodik.
94 unsur pertama terdapat secara alami, meskipun beberapa nya ditemukan dalam jumlah renik dan disintesis dalam laboratorium sebelum ditemukan di alam.
Unsur-unsur dari nomor atom 95 hingga 118 adalah unsur sintetis yang dibuat di laboratorium.
Unsur-unsur dari nomor 95 – 100 ditemukan di alam, tetapi saat ini tidak dijumpai lagi.
Sintesis unsur dengan nomor atom yang lebih besar masih terus dikembangkan.
Sejumlah radionuklida sintetis atau unsur yang berada di alam telah diproduksi di laboratorium.
Pelajari Materi Terkait
Sumber gini.com
EmoticonEmoticon