Energi kinetik (Ek) terdapat pada setiap benda bergerak yang besarnya sama dengan Ek = 1/2mv2. Gas ideal dalam sebuah wadah bergerak secara bebas dengan gerakan partikel-partikel gas memenuhi hukum Newton. Diketahui bahwa partikel-partikel gas dalam suatu wadah bergerak sehingga gas tersebut memiliki energi kinetik. Besar energi kinetik gas diturunkan dari persamaan besaran yang mempengaruhi gas. Berdasarkan hasil percobaan, besaran-besaran yang menentukan keadaan gas dalam ruangan tertutup adalah volume (V), tekanan (P), dan suhu gas (T). Pengaruh besaran tersebut dijelaskan dalam persamaan yang termuat dalam hukum-hukum tentang gas meliputi Hukum Boyle, Charles, Gay Lussac, dan Boyle–Gay Lussac.
Selanjutnya, bagaimana cara menghitung energi kinetik gas ideal? Bagaimanakah hubungan antara ketiga variabel yang mempengaruhi keadaan gas (tekanan, volume, dan suhu) terhadap energi kinetik gas tersebut? Sobat idschool dapat mencari tahu jawabannya melalui ulasan di bawah.
Hubungan Energi Kinetik dan Tekanan Gas
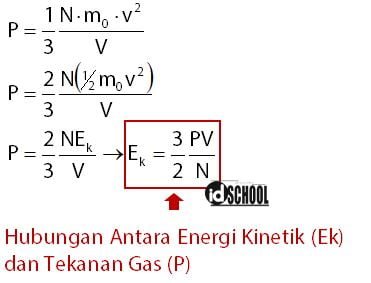
Sebuah percobaan dilakukan untuk mengetahui apa saja yang mempengaruhi tekanan gas dalam sebuah wadah tertutup. Kesimpulan yang didapat dari percobaan tersebut adalah besar tekanan partikel-partikel gas dalam suatu ruangan dipengaruhi oleh suhu gas dan volume gas. Tekanan gas timbul karena adanya tumbukan antara partikel gas dengan dinding wadahnya.
Adanya tumbukan menyebabkan terjadinya perubahan momentum sehingga partikel-partikel gas memiliki energi kinetik. Besarnya tekanan gas dalam sebuah wadah tertutup dinyatakan melalui persamaan berikut.

Besar energi kinetik (Ek) suatu benda bergerak dapat dinyatakan melalui persamaan Ek = 1/2·mv2. Persamaan gas memiliki besaran yang dipengaruhi oleh perkalian massa partikel gas (m0) dengan kuadrat kecepatan benda (v2). Sehingga, antara tekanan gas (P) dan besar energi kinetik partikel gas (Ek) dapat dinyatakan dalam sebuah persamaan.
Baca Juga: Cara Menghitung Kecepatan Peluru dengan Ayunan Balistik
Rumus Energi Kinetik dan Energi Dalam Gas Ideal
Persamaan gas ideal menyatakan hubungan antara tekanan (P), suhu (T), dan Volume (V) gas. Hubungan ketiga besaran tersebut dinyatakan dalam persamaan PV = nRT atau PV = NkT. Besar tekanan memiliki hubungan dengan besar energi kinetik, sehingga besar energi kinetik juga memiliki hubungan dengan suhu.
Ek = 3/2 ·PV/N
Ek = 3/2·NkT/N
Ek = 3/2kT
Hubungan antara suhu (T) dan energi kinetik (Ek) sebuah gas ideal dinyatakan seperti persamaan berikut.

Rumus energi kinetik di atas berlaku untuk satu partikel gas ideal. Bagaimana untuk N partikel gas ideal? Jika seluruh energi kinetik partikel tersebut dijumlahkan maka jumlah energi kinetik disebut energi dalam gas ideal (U). Energi dalam gas ideal dipengaruhi oleh derajat kebebasannya. Energi dalam (U) suatu gas ideal didefinisikan sebagai jumlah energi kinetik seluruh molekul gas dalam ruang tertutup yang meliputi energi kinetik translasi, rotasi, dan vibrasi.
Apabila dalam suatu ruang terdapat N molekul gas, maka energi dalam gas ideal U dinyatakan sebagai berikut.

Baca Juga: Pengertian Momentum dan Impuls, serta Hubungan Keduanya
Kelajuan Efektif Gas Ideal
Partikel-partikel gas dalam suatu wadah bergerak dengan laju dan arah yang beraneka ragam. Rata-rata kuadrat kecepatan partikel-partikel gas disebut dengan kecepatan efektif gas atau vrms (rms = root mean square). Persamaan untuk mencari kecepatan efektif gas dapat diperoleh dari penurunan rumus energi kinetik gas ideal. Ada empat persamaan yang dapat digunakan untuk menghitung kelajuan efektif gas ideal untuk beberapa besaran berbeda.
Kelajuan efektif gas ideal dapat dihitung melalui persamaan berikut.

Baca Juga: Energi Potensial, Energi Kinetik, dan Energi Mekanik
Contoh Soal dan Pembahasan
Beberapa contoh soal di bawah dapat sobat idschool gunakan untuk mengukur pemahaman di atas. Setiap contoh soal yang diberikan dilengkapi dengan pembahasan soal. Sobat idschool dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat Berlatih!
Contoh 1 – Soal Energi Kinetik Gas
Gas Hidrogen (Mr = 2) dan gas Oksigen (Mr = 32) berada di dalam ruangan yang sama. Besar energi kinetik rata-rata molekul O2 adalah ….
A. 16 kali energi kinetik rata-rata molekul H2
B. 4 kali energi kinetik rata-rata molekul H2
C. 1/4 kali energi kinetik rata-rata molekul H2
D. 1/16 kali energi kinetik rata-rata molekul H2
E. sama dengan energi kinetik rata-rata molekul H2
Pembahasan:
Besar enegri kinetik suatu gas dipengaruhi oleh suhu ruang tempat gas tersebut berada. Kesimpulan tersebut diperoleh dari persamaan energi kinetik yang dinyatakan dalam persamaan Ek = 2/3·kT. Nilai k meruapakan konstanta Boltzmann yang besar nilainya sama untuk gas Hidrogen (H2) atau Oksigen (O2). Kedua gas berada di dalam ruangan yang sama, sehingga suhu yang mempengaruhinya juga sama. Kesimpulannya, energi kinetik gas Oksigen akan sama dengan energi kinetik Hidrogen.
Jadi, besar energi kinetik rata-rata molekul O2 adalah sama dengan energi kinetik rata-rata molekul H2.
Jawaban: E
Contoh 2 – Soal Energi Kinetik Gas
Suatu gas ideal dalam ruang tertutup yang suhunya 27°C memiliki energi kinetik partikel sebesar 150 J. Besar energi kinetik gas tersebut setelah suhu dinaikkan adalah 300 J. Besar suhu setelah dinaikkan adalah ….
A. 150oK
B. 300oK
C. 450oK
D. 600oK
E. 750oK
Pembahasan:
Berdasarkan keterangan pada soal dapat diperoleh informasi-informasi seperti berikut.
- suhu ruang sebelum dinaikkan: T1 = 27° + 273o = 300oK
- energi kinetik partikel gas sebelum suhu dinaikkan: Ek1 = 150 J
- energi kinetik gas setelah suhu dinaikkan: Ek2 = 300 J
Menghitung suhu ruang setelah dinaikkan (T2):

Jadi, besar suhu dalam ruangan setelah dinaikkan adalah 600oK.
Jawaban: D
Baca Juga: Hukum Gay Lussac – Hukum Perbandingan Volume
Contoh 3 – Soal Energi Kinetik Gas Ideal
Suhu gas ideal dalam tabung dirumuskan sebagai Ek = 3/2kT, T menyatakan suhu mutlak dan E = energi kinetik rata-rata molekul gas. Berdasarkan persamaan di atas ….
A. semakin tinggi suhu gas, energi kinetiknya semakin kecil
B. semakin tinggi suhu gas, gerak partikel gas semakin lambat
C. semakin tinggi suhu gas, gerak partikel gas semakin cepat
D. suhu gas berbanding terbalik dengan energi kinetik gas
E. suhu gas tidak mempengaruhi gerak partikel gas
Pembahasan:
Besar energi kinetik gas ideal memiliki hubungan sebanding dengan suhu. Semakin besar kenaikan suhu, besar energi kinetik juga semakin besar. Energi kinetik dimiliki oleh benda yang bergerak dengan besarnya sebanding dengan kecepatan. Sehingga, kenaikan suhu akan membuat kecepatan partikel gas menjadi semakin cepat.
Jadi, berdasarkan persamaan Ek = 3/2kT dapat diperoleh kesimpulan bahwa semakin tinggi suhu gas, gerak partikel gas semakin cepat.
Jawaban: C
Contoh 4 – Soal Kelajuan Efektif Gas Ideal
Dalam ruangan yang bervolume 3 liter terdapat 400 miligram gas dengan tekanan 1 atm. Jika 1 atm = 105 N/m2, maka kelajuan rata-rata partikel gas tersebut adalah ….
A. 1,5 × 102 m/s
B. 1,5 × 103 m/s
C. 2,25 × 103 m/s
D. 3 × 103 m/s
E. 9 × 103 m/s
Pembahasan:
Berdasarkan keterangan yang diberikan pada soal dapat diperoleh informasi-informasii seperti berikut.
- volume ruangan: V = 3 liter = 3 dm3 = 3 × 10–3 m3
- massa gas: M = 400 miligram = 0,4 × 10–3 kg
- tekanan gas: P = 1 atm = 1 × 105 N/m2
Menghitung kelajuan efektif gas (vrms):
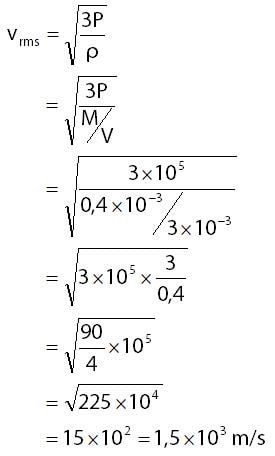
Jadi, kelajuan rata-rata partikel gas tersebut adalah 1,5 × 103 m/s.
Jawaban: B
Demikianlah tadi ulasan materi hubungan antara tekanan dan energi kinetik gas. Bahasan meliputi rumus energi kinetik gas serta penggunaan rumus tersebut untuk menyelesaikan suatu permasalahan. Terimakasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: Persamaan Umum Gas Ideal (PV = nRT)
Sumber gini.com
EmoticonEmoticon